


Article n° 138, publié le 25-Novembre-2017, par Christophe.
Catégorie(s) : plongée.



Attention, j'ai décidé de passer à des sujets très sérieux et de donner mon premier cours de «Math spé P», c'est-à-dire un cours de Mathématiques (et de physique) spécial Plongeur ! Certes, pour passer le concours de Polytechnique, ces connaissances vont être limitées (et si vous n'êtes qu'en «Math spé P», c'est déjà raté pour vous, il aurait fallu être en P'). Ce cours est aussi totalement anti-pédagogique, il est construit de manière à rendre fou tous les MF2 (moniteur fédéral 2nd degré) de la fédération française de plongée, mais je pense qu'une bonne dose de délire est nécessaire pour mieux apprendre des choses dont on n'a pas besoin de connaître en détail, pour plonger avec un scaphandre autonome. Par exemple, pas besoin de savoir qui est Mariotte, c'est complètement inutile, par contre, savoir ce qu'il a découvert est un peu plus utile mais pas en détail car on ne va pas commencer à calculer la quantité d'air à souffler dans son gilet stabilisateur pour remonter de 20 mètres de profondeur. Il faut juste savoir qu'il faudra le dégonfler pendant la remontée, sous peine de finir perché sur le mât du bateau, avec les poumons explosés !
Commençons par les bases, c'est-à-dire le port breton où ils n'ont pas inventé la plongée, mais où la plongée se pratique quand même par des plongeurs dépourvus de système nerveux, caractéristique anatomique important leur permettant de ne pas ressentir la température extrêmement réduite des eaux bretonnes (je viens de me mettre à dos tous les bretons, en plus des MF2, ça part bien cette histoire  ). Alors, les ports bretons ont comme spécificité de posséder un bar tous les 10 mètres (ce que les bretons ne peuvent contredire, vu la proportion d'alcooliques dans leurs rangs... Je blague, ce n'est qu'un préjugé
). Alors, les ports bretons ont comme spécificité de posséder un bar tous les 10 mètres (ce que les bretons ne peuvent contredire, vu la proportion d'alcooliques dans leurs rangs... Je blague, ce n'est qu'un préjugé  ). Sous l'eau, c'est pareil, on prend un bar tous les 10 mètres : 1 bar à la surface, second bar à 10 mètres de profondeur, troisième bar à 20 mètres, etc... D'accord, les bars bretons sont des débits d'alcool, alors que le bar pour la plongée est l'unité de mesure de pression (comme dans la bière pression servie dans les bars). 1 bar correspond à la pression atmosphérique moyenne à la surface de la mer (lieu idéal pour la plongée au passage). Et comme ceux qui ont inventé cette unité avait un côté plutôt pratique, ils ont choisi comme définition : 1 bar est égal à la pression exercée par une colonne de 10 mètre d'eau sur une surface donnée. Un cube de 1 m³, (1.000 dm³), rempli d'eau, c'est 1.000 litres d'eau qui exercent donc une force de pesanteur de 1.000 kg (ou, grosso modo, 10.000 newtons), sur la base du cube de 1 m². 10 cubes empilés les uns sur les autres, ce qui fait une colonne de 10 mètres de haut, remplie d'eau, exercent donc un poids de 10.000 kg sur un mètre-carré, c'est-à-dire la définition même du bar, CQFD (ou presque car il faudra utiliser des newtons et la véritable valeur de l'accélération de la pesanteur mais on ne va pas se prendre la tête pour si peu) ! Si vous n'avez rien compris, ce n'est pas grave, retenez juste le coup du bar tous les 10 mètres, comme dans les ports bretons, en commençant par le premier à surface : à 10 mètres de profondeur, la pression est de 2 bars, à 20 mètres de 3 bars, à 30 mètres de 4 bar et à 60 mètres, le plongeur est complètement bourré par l'ivresse des profondeurs car il a rencontré 7 bars (s'il s'est contenté d'un verre à chaque bar, déjà qu'avec trois verres, c'est bonjour les dégâts, avec 7 verres, c'est la catastrophe) !
). Sous l'eau, c'est pareil, on prend un bar tous les 10 mètres : 1 bar à la surface, second bar à 10 mètres de profondeur, troisième bar à 20 mètres, etc... D'accord, les bars bretons sont des débits d'alcool, alors que le bar pour la plongée est l'unité de mesure de pression (comme dans la bière pression servie dans les bars). 1 bar correspond à la pression atmosphérique moyenne à la surface de la mer (lieu idéal pour la plongée au passage). Et comme ceux qui ont inventé cette unité avait un côté plutôt pratique, ils ont choisi comme définition : 1 bar est égal à la pression exercée par une colonne de 10 mètre d'eau sur une surface donnée. Un cube de 1 m³, (1.000 dm³), rempli d'eau, c'est 1.000 litres d'eau qui exercent donc une force de pesanteur de 1.000 kg (ou, grosso modo, 10.000 newtons), sur la base du cube de 1 m². 10 cubes empilés les uns sur les autres, ce qui fait une colonne de 10 mètres de haut, remplie d'eau, exercent donc un poids de 10.000 kg sur un mètre-carré, c'est-à-dire la définition même du bar, CQFD (ou presque car il faudra utiliser des newtons et la véritable valeur de l'accélération de la pesanteur mais on ne va pas se prendre la tête pour si peu) ! Si vous n'avez rien compris, ce n'est pas grave, retenez juste le coup du bar tous les 10 mètres, comme dans les ports bretons, en commençant par le premier à surface : à 10 mètres de profondeur, la pression est de 2 bars, à 20 mètres de 3 bars, à 30 mètres de 4 bar et à 60 mètres, le plongeur est complètement bourré par l'ivresse des profondeurs car il a rencontré 7 bars (s'il s'est contenté d'un verre à chaque bar, déjà qu'avec trois verres, c'est bonjour les dégâts, avec 7 verres, c'est la catastrophe) !
Passons à maintenant une loi physique primordiale : tout milliardaire logé dans une suite de luxe d'un grand hôtel cannois, dépensera proportionnellement de sa fortune moins qu'un smicard dans un Formule 1 en banlieue... Zut, je devais parler de la loi de Mariotte, pas celle de Marriott (les hôtels de luxe) ! Mariotte pour les plongeurs aux connaissances limitées, c'est «P1 x V1 = P2 x V2» et elle ne s'applique qu'aux gaz, c'est-à-dire pour les plongeurs, l'air dans leurs poumons ou leur gilet stabilisateur. On s'en fout un peu de la formule, mais retenez bien que cette loi s'applique à l'air, pas à la bouteille de plongée (même si elle contient de l'air, on reviendra sur ce sujet) car c'est du métal, un solide qui, par définition, ne varie pas de volume, il est incompressible ! Cette loi ne s'applique pas non plus aux liquides, un litre d'eau reste un litre d'eau, quelle que soit la pression ambiante. Quant au plongeur, hormis l'air dans ses poumons, sa bouche, ses sinus, et le méthane dans ses intestins (gaz dégagé par la digestion et souvent émis sous forme de pets retentissants et malodorants), il est composé de liquides, le sang et autres sécrétions (qui contiennent beaucoup, beaucoup d'eau), ou de solides comme les os. Il est donc aussi en grande partie incompressible. Cela dit, «P1 x V1 = P2 x V2» explique simplement que quand on prend un gaz, par exemple de l'air dans un gilet stabilisateur et qu'on exerce une pression sur lui, par exemple en le descendant à 10 mètres de profondeur, le volume du gaz «V» va diminuer d'autant que la pression «P» augmente (ou vice-versa, si la pression augmente, le volume du gaz va diminuer d'autant) et cela de manière proportionnelle. Cela veut donc dire que si un plongeur a gonflé son gilet stabilisateur par 20 mètres de profondeur, celui-ci va avoir un volume de plus en plus important au fur et à mesure que le plongeur remonte à la surface où son gilet aura triplé de volume par rapport à son volume initial par 20 mètres de profondeur car la pression ambiante aurait été divisée par 3 entre 20 mètres et la surface. Et c'est là qu'il est important de passer au chapitre suivant avec le bon vieil Archimède !
Un litre d'eau pèse un kilo, c'est la définition même du kilo, ou du litre. L'eau étant l'élément le plus important pour la vie, les scientifiques ont donc choisi cet élément comme référence pour définir des unités de mesure, à l'instar de monsieur Celsius qui a choisi la température de congélation de l'eau pour définir le 0 °C et la température d'ébullition de l'eau pour les 100 °C (alors que monsieur Fahrenheit a préféré se fourrer son thermomètre dans le derrière, mais chacun fait ce qu'il veut). Ensuite, Archimède a pris son bain et il s'est aperçu, en remplissant sa baignoire à ras bord, que si un objet déplaçait une masse d'eau supérieure à la masse de l'objet, il flottait et qu'à contrario, si la masse d'eau déplacée était inférieure à la masse de l'objet, celui-ci coulait ! Il en a conclu que l'eau (ou tout autre liquide) exerçait une force sur tout objet immergé et il s'est empressé de nommer cette force, la poussée d'Archimède ! Et comme un kilo, c'est un litre d'eau, et vice-versa, cela va simplifier les calculs pour les plongeurs. Prenons, par exemple, prenons un plongeur équipé d'un bloc de plongée et d'un gilet de stabilisation, qui pèse 90 kg, tout compris, et qui a un volume de 100 litres (avec son gilet un peu gonflé) : il va flotter, car les 90 kg du plongeur sont inférieurs aux 100 litres d'eau, donc aux 100 kg d'eau, qu'il a déplacé en s'immergeant dans une baignoire (une grosse baignoire) ! Si ce plongeur vide un peu d'air de son gilet de stabilisation, et que son volume passe à 85 litres, il va couler : les 90 kg du plongeur sont alors supérieurs au poids des 85 litres d'eau. S'il renvoie de l'air dans son gilet, disons 5 litres, il va arrêter de couler, mais il ne remontera pas car la pesanteur (le poids du plongeur), var être égale à la poussée d'Archimède (qui correspond au poids des 90 litres d'eau). Le plongeur va rester entre deux eaux, état très intéressant pour celui-ci car il n'aura plus besoin de palmer pour rester à la même profondeur (on ne va quand même pas commencer à faire du sport en plongée et palmer comme des malades) ! Ajoutons un plomb de 1 kg à ce plongeur, il devra gonfler son gilet de presque 1 litre pour rester à la même profondeur (car le volume du plomb est petit). Maintenant, croisons Mariotte avec Archimède (événement improbable car le mariage gay n'existait pas à l'époque) : que se passe-t-il si ce plongeur de 85 kg et d'un volume de 85 litres, descend de 10 à 20 mètres de profondeur ? Il va passer de 2 à 3 bars, l'air de son gilet va être réduit à de (2 / 3) fois son volume initial, le volume total du plongeur va donc être plus petit mais il aura conservé le même poids (la plongée ne fonctionne pas pour les régimes amaigrissants), il va donc couler ! Il lui faudra alors renvoyer de l'air dans son gilet stabilisateur pour flotter à nouveau entre deux eaux !
Petit exercice pour savoir si vous avez bien compris : soit une ancre de 50 kg et d'un volume de 5 litres, posé par 10 mètres de fond, quel volume aura-t-elle à la surface ? Vous avez 2 secondes... Alors ? Oui, c'était un piège, une ancre est un solide, elle ne se déforme pas en fonction de la pression, contrairement au crane du plongeur s'il reçoit une ancre sur la tête. D'ailleurs, revenons à l'air comprimé dans la bouteille de plongée de, par exemple, 12 litres gonflée à 200 bars ! Si on applique la loi du mariolle de Mariotte, en équivalent surface, c'est-à-dire à 1 bar, ça fait 12 l x 200 b, soit l'équivalent de 2400 l x 1 bar («P1 x V1 = P2 x V2»). Mais faire ce calcul en surface, n'a pas vraiment d'intérêt. A 20 mètres de profondeur, ça devient plus intéressant car la pression délivrée par le second étage du détendeur va être de 3 bars (un détendeur de plongeur délivre l'air à la pression ambiante). Le plongeur aura donc, un équivalent de (12 l * 200 b) / 3 b = 800 litres ! S'il respire, en moyenne, 20 litres par minutes, ça lui fera donc une autonomie en air de 40 minutes ! A 40 mètres, c'est-à-dire avec son détendeur qui délivre une pression de 5 bars, ça lui fera l'équivalent de (12 l * 200 b) / 5 b = 480 litres, soit 24 minutes d'autonomie en air. Ce qui veut dire que plus un plongeur descend, moins il a d'autonomie en air ! Et par conséquence, plus un plongeur descend profond, plus il devra faire de paliers de décompression en fin de plongée, plus il devra faire attention à son manomètre au cours de la plongée ! Mais au fait, pourquoi faire des paliers de décompression ? Dalton et Henri vont nous l'expliquer dans les prochains chapitres !
Dalton dit que, sous la pression de Lucky Luke, les Daltons (de Jack à Averell) essaient de se fondre dans la masse... Oui, d'accord, John Dalton (non, il n'est pas dans la bande dessinée de Morris et Goscinny) ne dit pas tout à fait ça ! Il dit juste que pour un mélange gazeux, comme l'air composé (grosso modo, pour simplifier les calculs) de 20 % d'oxygène et de 80 % d'azote, soumis à une pression de P bars, chaque gaz le composant est alors soumis à une pression partielle, en rapport avec leurs proportions dans le mélange. La pression partielle d'oxygène, sera de P x 20 % bars (ou P x 0,20) et celle de l'azote sera de P x 80 % bars (ou P x 0,80). En plus, dans les poumons d'un plongeur, il y a aussi du CO2, gaz qui se mélange avec l'oxygène et l'azote, ce CO2 va donc aussi avoir une pression partielle. Le plus important à retenir est de savoir que ces gaz ont des effets sur nos organismes à partir de certaines pressions partielles, comme par l'exemple, l'azote qui provoque l'ivresse des profondeurs (ou narcose pour les initiés), le CO2 qui va provoquer à partir d'un certain seuil de pression partielle, un reflexe inspiratoire ou à un seuil plus important, une syncope, et enfin, même l'oxygène est nocif au-delà d'une certaine pression partielle. Ce ne n'est pas spécialement important de savoir calculer ces pressions partielles, il faut juste savoir que ce calcul permet de déterminer les limites de profondeur pour un plongeur loisir (par exemple, 60 m pour une plongée à l'air, mais moins avec du Nitrox où le pourcentage d'oxygène dans le mélange sera plus important) et que par conséquence, ces limites de profondeurs ne sont pas là pour entraver la liberté des plongeurs mais pour les garder en bonne santé !
Henry : lui, il a dû réussir sa vie, être aimer et gagner de l'argent... Enfin, peut-être... En tous cas, il était certainement très intelligeant car il a découvert une loi physique qui, bien évidemment, porte son nom. Au passage, il devait être un grand consommateur de Perrier, ou de Badoit, voire de San Pellegrino, car il découvert pourquoi il y avait des petites bulles d'eau dans ses eaux gazeuses préférées ! En fait, il s'est accoquiné avec Dalton et il s'est rendu compte que, quand on augmentait la pression partielle d'un gaz, celui-ci se dissolvait, à une certaine vitesse, dans les liquides jusqu'à une certaine limite (la saturation) et que si on re-diminuait la pression, le gaz «ressortait», à la même vitesse, du liquide, sous forme de petites bulles. Et de quoi est composé en grande partie un plongeur ? D'eau, un liquide... Et que respire le plongeur ? De l'air, comprimé... Henry nous explique donc que les gaz composant l'air vont se dissoudre dans le plongeur. Donc, quand un plongeur descend, les gaz, vont commencer à se dissoudre dans son organisme. Le gros problème provient surtout de l'azote, avec ses grosses molécules, contenu en grande quantité dans l'air. Ce gaz va se dissoudre dans le corps du plongeur, dans son sang, dans ses muscles, son cerveau, sa moelle osseuse, bref différents tissus (aussi appelés compartiments), et cela à des vitesses différentes en fonction du tissu. Cette dissolution se fera plus ou moins vite en fonction de la pression partielle de l'azote, donc de la pression ambiante qui est directement liée à la profondeur, et du temps passé à cette profondeur. Donc, plus le plongeur descend profond, plus il reste longtemps au fond, plus l'azote se dissout dans son corps. Et à la remontée, quand la pression va diminuer, l'azote va «ressortir», plus ou moins rapidement, en fonction de la vitesse de remontée et de l'agitation du plongeur (comme une bouteille de Perrier que l'on ouvre brusquement ou doucement, après l'avoir secouée ou pas, c'est fou, non ?). Et si le plongeur remonte trop vite, sans faire de pallier, en faisant un gros effort, des grosses bulles d'azote, dont la taille va augmenter au fur et à mesure que la pression diminue (cf Mariotte), vont se former dans son organisme et si ces bulles se forment et se bloquent au mauvais endroit (cerveau...), ça peut très mal se finir pour le plongeur !
Exemple de dissolution de l'azote dans des tissus (courbes orange, rouge et violette) en fonction du temps et de la profondeur de la plongée (courbe bleue) :
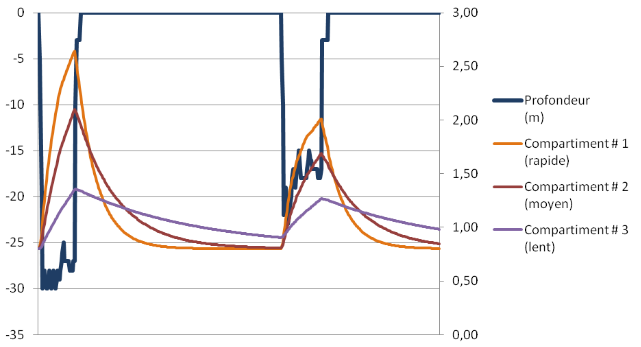
Mais, pas de problème, aujourd'hui, il existe des ordinateurs de plongée qui vont tout calculer pour les plongeurs et leur dire quand faire des paliers en fonction du profil de leur plongée. Par contre, il incombe au plongeur de faire attention à sa vitesse de remontée (la vitesse de remontée est en fonction des caractéristiques de l'ordinateur dont il faudra lire la notice d'utilisation), de ne pas faire de gros efforts (en fin de plongée, mais aussi après la plongée car une fois de retour à la surface, l'azote continue de ressortir des différents tissus du corps humain). Le plongeur devra aussi prévoir le cas où son ordinateur tomberait en panne (une panne de pile, ça arrive plus souvent qu'on le croit) et là, les tables de plongée ont toutes leurs importances. Chaque plongeur possède bien évidemment dans la poche de son gilet de stabilisation, des tables de plongée qui peuvent servir à planifier sa prochaine plongée, pour savoir ce qu'il compte faire comme profil de plongée et s'y tenir (et grâce à l'ordinateur d'un autre membre de la palanquée qui ne sera pas tombé en panne et qui donnera la profondeur maximale atteinte, par ce plongeur certes, et le temps passé sous l'eau, le plongeur en panne d'ordinateur aura une idée du taux de dissolution de l'azote dans son corps, donc une indication du temps des paliers à faire, même si dans l'absolu, ce n'est pas l'idéal mais il faut mieux faire ça que rien du tout).
Maintenant, revenons à plus basique : la propagation des ondes dans l'eau, milieu où barbotent généralement les plongeurs, c'est C² = 1 / β où β est le coefficient de compressibilité de l'eau de mer (et je crois bien avoir dit que les liquides étaient incompressibled, zut, damned, je suis fait  ). Bref, les sons se propagent bien sous l'eau et en particulier les sons graves (basses fréquences). Les ondes acoustiques sont d'ailleurs le meilleur moyen de communication sous l'eau. L'absorption due à la conversion d'énergie acoustique en chaleur et énergie chimique dépend par contre fortement de la fréquence. Aux hautes fréquences l'absorption est principalement due à la viscosité de l'eau, alors qu'aux basses fréquences, elle est due à la relaxation de l'acide borique B(OH)3 et du sulfate de magnésium MgSO4. Le processus de relaxation consiste en l'absorption d'énergie par changement de structure moléculaire au passage de l'onde acoustique et conduit à la dissociation des molécules et hydratation des ions... Vous avez tout compris ? Parfait ! Si comme moi, vous vous demandez pourquoi il y a de l'acide borique B(OH)3 dans l'eau de mer, sachez qu'il n'y a finalement qu'une seule chose à retenir : sous l'eau, on peut entendre un bateau de très loin et quant au chant des baleines, composé de fréquences basses, on peut l'entendre à des kilomètres...
). Bref, les sons se propagent bien sous l'eau et en particulier les sons graves (basses fréquences). Les ondes acoustiques sont d'ailleurs le meilleur moyen de communication sous l'eau. L'absorption due à la conversion d'énergie acoustique en chaleur et énergie chimique dépend par contre fortement de la fréquence. Aux hautes fréquences l'absorption est principalement due à la viscosité de l'eau, alors qu'aux basses fréquences, elle est due à la relaxation de l'acide borique B(OH)3 et du sulfate de magnésium MgSO4. Le processus de relaxation consiste en l'absorption d'énergie par changement de structure moléculaire au passage de l'onde acoustique et conduit à la dissociation des molécules et hydratation des ions... Vous avez tout compris ? Parfait ! Si comme moi, vous vous demandez pourquoi il y a de l'acide borique B(OH)3 dans l'eau de mer, sachez qu'il n'y a finalement qu'une seule chose à retenir : sous l'eau, on peut entendre un bateau de très loin et quant au chant des baleines, composé de fréquences basses, on peut l'entendre à des kilomètres...
Quant aux ondes électromagnétiques, comme les ondes GPS, la Wifi ou le téléphone cellulaire, elles ne passent pas sous l'eau ! Et pour vous en convaincre, regardez un micro-onde : si les ondes traversaient sans problème le bol d'eau, elles ne chaufferaient pas l'eau ! Oui, c'est une explication à deux balles mais si ça marchait, ça se saurait (même si, trop souvent, ça marche dans les films hollywoodiens, mais c'est du gros bobard, pas la réalité). Mais si vous voulez faire une expérience par vous-même balancez votre tout dernier smartphone dans l'eau de mer : il ne marchera pas (et ne fonctionnera plus, s'il n'était pas étanche) ! Autre phénomène de propagation des ondes sous l'eau : la lumière (qui est une onde) mais j'ai déjà tout expliqué dans les deux derniers articles de ce blog, prière de les lire en détail.
En résumé, je n'ai pas fait trop de schémas pour tout expliquer mais c'était fait exprès car voici, en dessin, ce qu'un plongeur loisir doit retenir : plus, un plongeur descend, plus la pression augmente et plus les gaz diminuent de volume et se dissolvent dans le plongeur ! A la remontée, la pression diminue, le volume des gaz augmente et des bulles se forment dans le plongeur, d'autant plus qu'il est resté longtemps au fond et qu'il palme comme un malade ! Donc, si on modélise un plongeur par un plomb et un ballon de baudruche rempli d'un peu d'eau et d'air, ça donne ça :
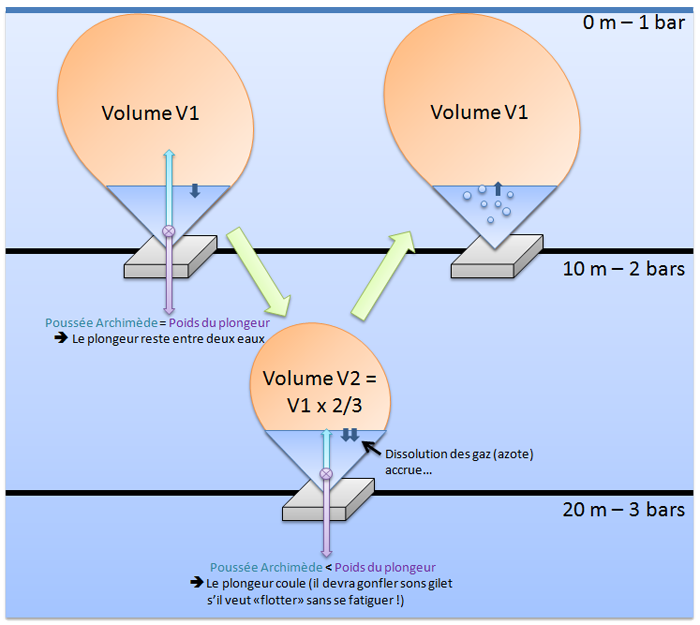
Et pour finir, un petit exercice : un plongeur, plongeant à l'air, découvre une viielle ancre d'une galère romaine de 46 kg et d'un volume de 14 litres, par 62 mètres de fond. Il essaie alors de la remonter, que va-t-il se passer ?
1- Il va se faire épingler par les affaires maritimes en rentrant au port avec l'ancre.
2- En tentant de remonter l'ancre sans utiliser un parachute, il va sombrer dans la narcose.
3- Qu'est-ce que faisait ce plongeur à 62 mètres ?
Vous avez 30 millisecondes... Solution : toutes les réponses sont bonnes ! Et si vous ne savez pas pourquoi un plongeur ne devrait pas se trouver par 62 mètres de fond, à l'air, relisez donc l'article ! Au fait, dans 3 semaines, je compte publier un nouvel article de la plus haute importance pour les plongeurs hexagonaux (mais qui peut aussi concerner les plongeurs grecs, turcs ou jordaniens), même si cela ne me concerne pas car je me considère principalement comme plongeur antillais !
